Wir werden häufig gefragt, ob Minitab von der U.S. Food and Drug Administration (FDA) für den Einsatz in der Pharmaindustrie validiert ist.
Minitab führt umfangreiche interne Softwaretests durch, unsere statistische Software ist aber nicht standardmäßig FDA-konform – und kann dies auch nicht sein.
Keine Software kann das.
Es wird oft fälschlicherweise angenommen, dass Softwarehersteller eine Zertifizierung durchlaufen können, um eine FDA-Softwarevalidierung zu erhalten. Das stimmt aber nicht.
Softwarehersteller, die angeben, dass ihre Produkte FDA-validiert sind, sollten unbedingt hinterfragt werden. Der Käufer einer Software ist dafür zuständig, die in der Produktion oder als Teil eines Qualitätssystems eingesetzten Produkte im Hinblick auf die vorgesehene Verwendung zu validieren. Dies wird im Code of Federal Regulations (Title 21 Part 820.70(i)) der FDA erläutert:
„Wenn Computer oder automatisierte Datenverarbeitungssysteme im Rahmen der Produktion oder eines Qualitätssystems eingesetzt werden, muss der Hersteller die Computersoftware im Hinblick auf die vorgesehene Verwendung gemäß einem festgelegten Protokoll validieren. Alle Änderungen an der Software müssen vor der Genehmigung und Veröffentlichung validiert werden. Die Maßnahmen und Ergebnisse der Validierung müssen dokumentiert werden.”
Für Medizintechnikunternehmen nennt die FDA weitere Informationen in Abschnitt 6 unter „Validation of Automated Process Equipment and Quality System Software“ in „Principles of Software Validation; Final Guidance for Industry and FDA Staff“ (11. Januar 2002).
„Der Gerätehersteller ist dafür verantwortlich sicherzustellen, dass die vom OTS-Softwareentwickler (Off the shelf, Standardsoftware) eingesetzten Verfahren für die Produktentwicklung geeignet und ausreichend für die vorgesehene Nutzung der OTS-Software durch den Gerätehersteller sind. Für OTS-Software und -Geräte kann der Gerätehersteller Zugang zur Dokumentation der Software-Validierung durch den Hersteller haben, dies ist aber nicht immer der Fall. Wenn der Hersteller Informationen zu den Systemanforderungen, Softwareanforderungen, Validierungsverfahren und Ergebnissen der Validierung vorlegen kann, kann der Medizintechnikproduzent diese Informationen aus Ausgangspunkt für die benötigte Validierungsdokumentation nutzen.”
Intended Use (vorgesehene Verwendung)
Es gibt gute Gründe für die Vorgaben zur „geplanten Verwendung“. Hierzu ein Beispiel:
Unternehmen XYZ verwendet Minitab Statistical Software, um die Wahrscheinlichkeit eines Fehlers in einem Herstellungsprozess zu schätzen. Wenn die Menge einer Verunreinigung 450 mg/ml überschreitet, wird das Produkt als fehlerhaft betrachtet. Angenommen, das Unternehmen setzt die Funktion „Prozessfähigkeitsanalyse“ > „Normal“ in Minitab statistische Software für die Prozessfähigkeitsanalyse ein.
In der ersten Grafik unten sehen Sie, dass der Ppk-Wert (1,26) und die Fehlerrate (82 Fehler pro Million) allgemein betrachtet recht gut sind. Wenn der Hersteller jedoch auf der Grundlage dieser Zahlen der Meinung wäre, dass dies ein guter Prozess ist, wäre dies falsch.
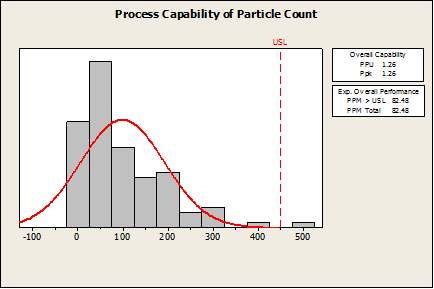
In der Minitab Statistiksoftware wurde nichts falsch berechnet, doch da die Daten nicht normalverteilt sind, wurde das falsche Verfahren angewendet. Wenn dies die einzige verfügbare Prozessfähigkeitsanalyse in Minitab statistische Software wäre, könnte die Software nicht für eine Prozessfähigkeitsanalyse mit nicht normalverteilten Daten validiert werden.
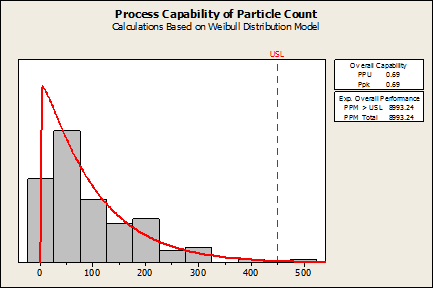
Glücklicherweise gibt es in der Minitab Statistical Software aber eine solche Prozessfähigkeitsanalyse. Wenn „Prozessfähigkeitsanalyse“ > „Nicht normal“ mit einer geeigneten Verteilung ausgewählt wird (in diesem Fall Weibull), werden der Ppk-Wert (0,69) und die Fehlerrate (8993 Fehler pro Million) als schlecht bewertet, wie in der folgenden Grafik dargestellt
Was muss validiert werden?
Softwarepakete wie Minitab, mit denen ein Prozess überwacht und das Qualitätsniveau bestimmt werden kann, sollten validiert werden. Zum Validieren von Minitab müssen Sie die „vorgesehene Verwendung“ dokumentieren.
Die Validierung im Hinblick auf die vorgesehene Verwendung besteht darin, die Softwareanforderungen Testfällen zuzuordnen. Jede Anforderung muss einem Testfall entsprechen. Bei der Prüfung kann ein System als „nicht validiert“ kategorisiert werden, wenn eine Anforderung ohne Testfall festgestellt wird.
Sie können Anforderungen und Testfälle mit einer Abhängigkeitenmatrix überwachen.
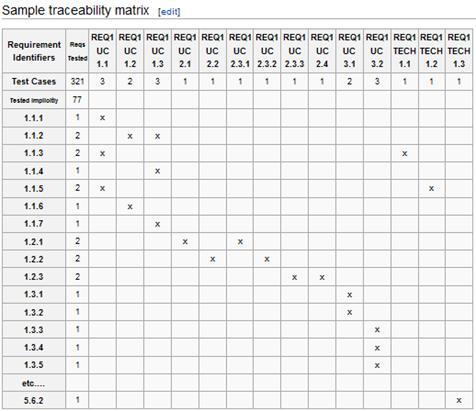
Ein Testfall sollte Folgendes umfassen:
- Eine Beschreibung des Testfalls. Beispiel: Validierung der Prozessfähigkeitsanalyse für nicht normalverteilte Daten.
- Ausführungsschritte. Beispiel: „Statistik“ > „Qualitätswerkzeuge“ > „Prozessfähigkeitsanalyse“ > „Nicht normal“ öffnen, die auszuwertende Spalte eingeben und die geeignete Verteilung auswählen.
- Testergebnisse (mit Bildschirmabzügen).
- Bestimmung, ob der Test bestanden/nicht bestanden wurde.
- Datum und Unterschrift des Prüfers.
Warnschreiben zur Software-Validierung
Viele Warnschreiben, die Hersteller erhalten, verweisen auf eine Verletzung dieser Vorgaben. Unten finden Sie einen Absatz aus einem Warnschreiben, in dem auf eine fehlerhafte Validierung eines OTS-Softwareprodukts für Helpdesks und eines Tools für die Dokumentenverwaltung verwiesen wird
29.05.2009
Fehlende Validierung von Computersoftware im Hinblick auf die vorgesehene Verwendung gemäß einem vorgegebenen Protokoll, wenn Computer oder automatisierte Datenverarbeitungssysteme im Rahmen der Produktion oder eines Qualitätssystems eingesetzt werden, wie gemäß 21 CFR § 820.70(i) gefordert. Dies ist ein wiederholter Verstoß in Bezug auf einen früheren FDA-483 für Ihr Unternehmen. Beispiele:
A) Ihr Unternehmen verwendet OTS-Software (***** Help Desk), um Anrufe beim Kundensupport zu verwalten und Konfigurationsinformationen zu Kunden-Websites zu speichern. Die Software wurde aber nicht ausreichend validiert, um sicherzustellen, dass sie für diesen Anwendungsfall wie vorgesehen funktioniert. Insbesondere wurde bei der Validierung durch Ihr Unternehmen nicht sichergestellt, dass der Detailbildschirm wie vorgesehen funktioniert. Auf dem Detailbildschirm werden Details zu Beschwerden sowie Informationen zur Bearbeitung der Beschwerden erfasst. Dazu gehören u. a. Korrektur- und Präventionsmaßnahmen, die Ihr Unternehmen ergreift, wenn Serviceanrufe als CAPA-Probleme kategorisiert werden.
B) OTS-Software (***************) wird von Ihrem Unternehmen für die Verwaltung von Dokumenten im Qualitätssystem zur Kontrolle und Genehmigung von Dokumenten eingesetzt. Diese Software wurde aber nicht ausreichend validiert, um sicherzustellen, dass sie Ihre Anforderungen erfüllt und für die vorgesehene Verwendung geeignet ist. Genauer gab es zum Zeitpunkt der Prüfung zwei unterschiedliche Versionen des Verfahrens für CAPA und Kundenbeschwerden (SOP-200-104), in der Dokumentenhistorie für *************** wurde jedoch kein Überarbeitungsverlauf angegeben. Ihr Unternehmen konnte nicht validieren, dass die Software *************** Ihre Anforderungen für die Dokumentverwaltung und Versionsverwaltung erfüllt.
Dies sind zwei weitere Beispiele für Verstöße bei der Software-Validierung in einem Warnschreiben der FDA:
25.03.2010
„Fehlende Validierung von Computersoftware im Hinblick auf die vorgesehene Verwendung gemäß einem vorgegebenen Protokoll, wenn Computer oder automatisierte Datenverarbeitungssysteme im Rahmen der Produktion oder eines Qualitätssystems eingesetzt werden, wie gemäß 21 CFR 820.70(i) gefordert.“ … „auf Anfrage wurde keine Validierungsdokumentation für das kommerzielle OTS-Programm (b)(4) zum Erfassen von Beschwerden, Retouren und Serviceanforderungen bereitgestellt.“
25.02.2010
„Fehlende Validierung von Computersoftware im Hinblick auf die vorgesehene Verwendung gemäß einem vorgegebenen Protokoll, wenn Computer oder automatisierte Datenverarbeitungssysteme im Rahmen der Produktion oder eines Qualitätssystems eingesetzt werden, wie gemäß 21 CFR §820.70(i) (Produktions- und Prozesssteuerung – automatisierte Prozesse) gefordert.“ … „die CAPA-Analyse der Unzulänglichkeiten, die in Management-Meetings eingesetzt wird, ist nicht ausreichend, weil der Bericht auf einem Computer mit einem nicht validierten Softwaresystem generiert wird.“
Validierungsressourcen von Minitab
Es liegt in der Verantwortung des Käufers der Software, die Software im Hinblick auf die vorgesehene Verwendung zu validieren. Wenn Sie die Minitab Statistical Software verwenden, stellen wir Ihnen Ressourcen für diese Validierung bereit. Sie können das Software-Validierungs-Kit von Minitab hier herunterladen
Dieses Software-Validierungs-Kit soll Ihnen veranschaulichen, wie wir die Marktreife der Minitab Statistical Software überprüfen, und den hohen Qualitätsstandard von Minitab demonstrieren.
Wenn Sie Fragen zum Validierungsverfahren für unsere Software haben, wenden Sie sich an uns.
Gute Herstellungspraxis in der Pharmazie:
regelkonforme kontinuierliche Prozessüberprüfung mit Minitab Solutions Analytics™
Hersteller von pharmazeutischen Produkten müssen ihre Prozesse kontinuierlich überprüfen (CPV), damit sie den regulatorischen Anforderungen (GMP) entsprechen und die Kundenvorgaben erfüllen. Nehmen Sie an unserem 60 minütigem Webinar am 15. September teil, um ein Beispiel für die Prozessverbesserung zur Erfüllung der Leistungsanforderungen aus der Praxis zu sehen. Melden Sie sich an >




![[Webinar] Gute Herstellungspraxis in der Pharmazie: Regelkonforme kontinuierliche Prozessüberprüfung mit Minitab Solutions Analytics](https://blog.minitab.com/hs-fs/hubfs/B2BML%20-%20NEW%20FILE%20MANAGER%20STRUCTURE/Blog%20Images/Imported_Blog_Media/f124447c-1e0f-4892-b03f-2518fe7d48ba-Jul-05-2025-10-47-12-6297-PM.jpg?width=1024&height=512&name=f124447c-1e0f-4892-b03f-2518fe7d48ba-Jul-05-2025-10-47-12-6297-PM.jpg)