La validation des logiciels dans l'industrie pharmaceutique est un aspect critique.
Dans cet article, nous répondons à une question fréquemment posée, à savoir si Minitab a été validé par la Food and Drug Administration américaine (FDA) pour être utilisé dans l’industrie pharmaceutique et des dispositifs médicaux.
Minitab effectue des tests approfondis pour valider ses logiciels en interne, mais en réalité, le logiciel Minitab n'est pas - et ne peut pas - être validé par la FDA.
En fait, aucun logiciel ne peut être validé par la FDA.
Il est faux de penser que les éditeurs de logiciels peuvent au travers d’un processus de certification, obtenir une validation du logiciel de la part de la FDA. Ce n'est tout simplement pas vrai.
Les fournisseurs de logiciels qui prétendent que leurs produits ont été validés par la FDA devraient être considérés avec suspicion. Il appartient à l'acheteur du logiciel lui-même, de valider les logiciels utilisés dans la production ou dans le cadre d'un système de qualité pour « l'utilisation prévue » de ce logiciel. Ceci est décrit dans une des directives de la FDA Titre 21 section 820.70 (i) :
«Lorsque des ordinateurs ou des systèmes automatisés de traitement de données sont utilisés dans le cadre de la production ou du système de qualité, le fabricant doit valider les logiciels pour l'utilisation prévue selon un protocole établi. Tous les changements de logiciels doivent être validés avant approbation et mise en place. Ces activités et résultats de validation doivent être documentés.»
La FDA fournit des informations supplémentaires pour assister les entreprises de dispositifs médicaux dans la Section 6 de la «Validation de l'automatisation des procédés et des logiciels du système de qualité» selon les Principes de validation des logiciels; Directives finales pour l'industrie et pour le personnel de la FDA, du 11 janvier 2002.
«Le fabricant de l'appareil doit s'assurer que les méthodologies de développement de produits utilisées par le développeur de logiciels sont appropriées et suffisantes pour l'utilisation prévue par le fabricant du dispositif de ce logiciel. Pour les logiciels et équipements, le fabricant de l'appareil peut ou non avoir accès à la documentation de validation logicielle du fournisseur. Si le fournisseur peut fournir des informations sur les exigences système, les exigences logicielles, le processus de validation et les résultats de leur validation, le fabricant du dispositif médical peut utiliser ces informations comme point de départ de la documentation de validation requise.»
Utilisation prévue
Il existe de très bonnes raisons pour que l’on se réfère au concept d’ «utilisation prévue». En voici un exemple :
La société XYZ utilise Minitab pour estimer la probabilité d'un défaut dans un processus de fabrication. Si la quantité d'une impureté excède 450 mg / mL, le produit doit être considéré comme défectueux. Supposons que la fonction Analyse de la capabilité dans Minitab > Normal, soit utilisée pour effectuer une analyse de capabilité justement.
Dans le premier graphique ci-dessous, vous pouvez noter que le Ppk (1,48) et le taux de défectueux (4,35 défectueux par million) sont satisfaisants par rapport à la plupart des normes. Cependant, ces valeurs apportent une information biaisée.
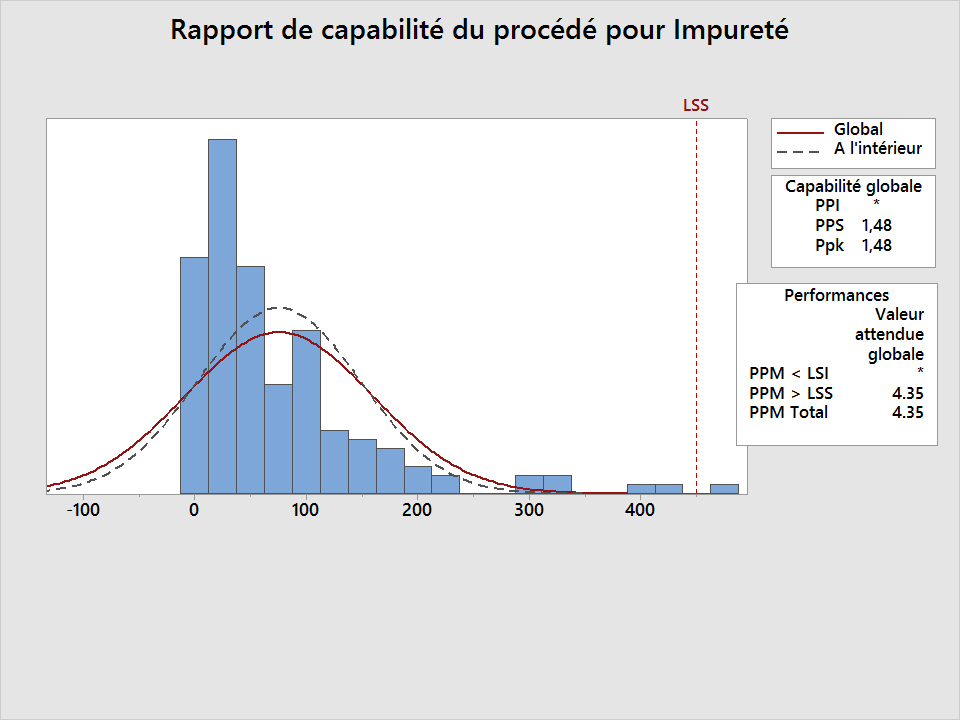
Minitab n'a rien calculé de façon incorrecte, mais étant donné que ces données sont non normales, une mauvaise approche a été utilisée. S'il s'agissait de la seule analyse de capabilité disponible dans Minitab, le logiciel ne pourrait pas être validé pour une analyse de capabilité non normale.
Heureusement, Minitab possède la fonction « Analyse de capabilité non normale ». Si l'Analyse de Capabilité> Non-normale est choisie et une distribution appropriée est sélectionnée (Weibull dans ce cas), le Ppk (0,88) et le taux de défauts (4234 défauts par million) se révèlent médiocres, comme le montre le graphique suivant :
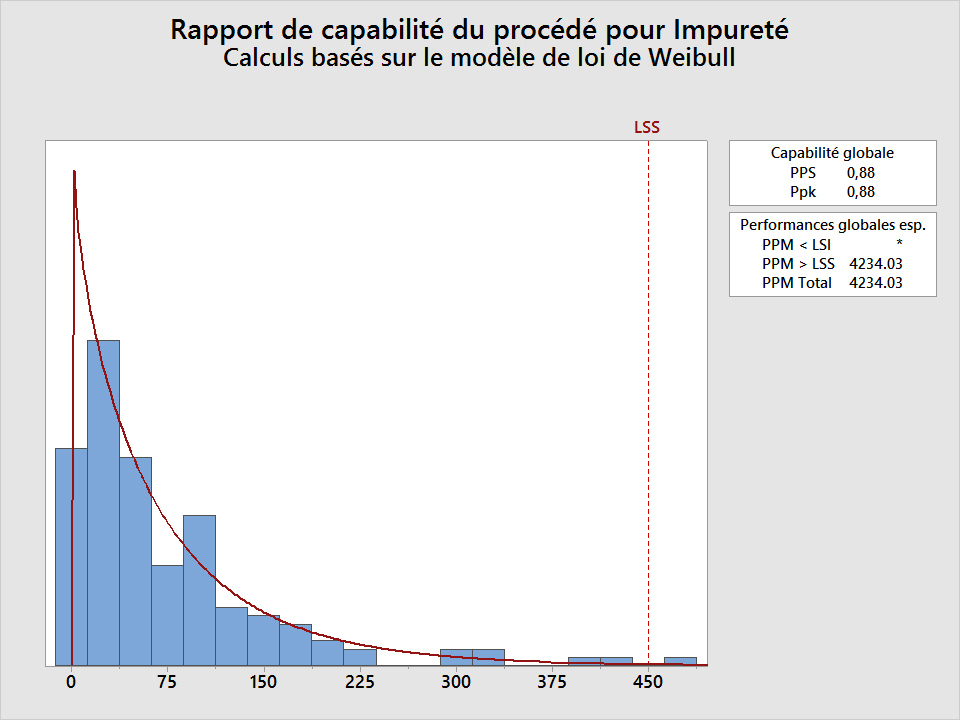
Comment valider un logiciel ?
Les logiciels qui sont utilisés pour surveiller les procédés et déterminer le niveau de qualité, comme Minitab, doivent être validés. Pour valider Minitab, vous devez documenter son utilisation prévue.
La validation pour l'utilisation prévue consiste à cartographier les exigences logicielles pour tester les différents cas possibles. Chaque exigence doit se rapporter à un cas spécifique. Un auditeur peut constater qu'un système «n'a pas été validé» si une exigence a été identifiée sans que le test correspondant n’ait été effectué.
Vous pouvez utiliser une matrice de traçabilité pour suivre vos besoins et vos tests.
Matrice de traçabilité
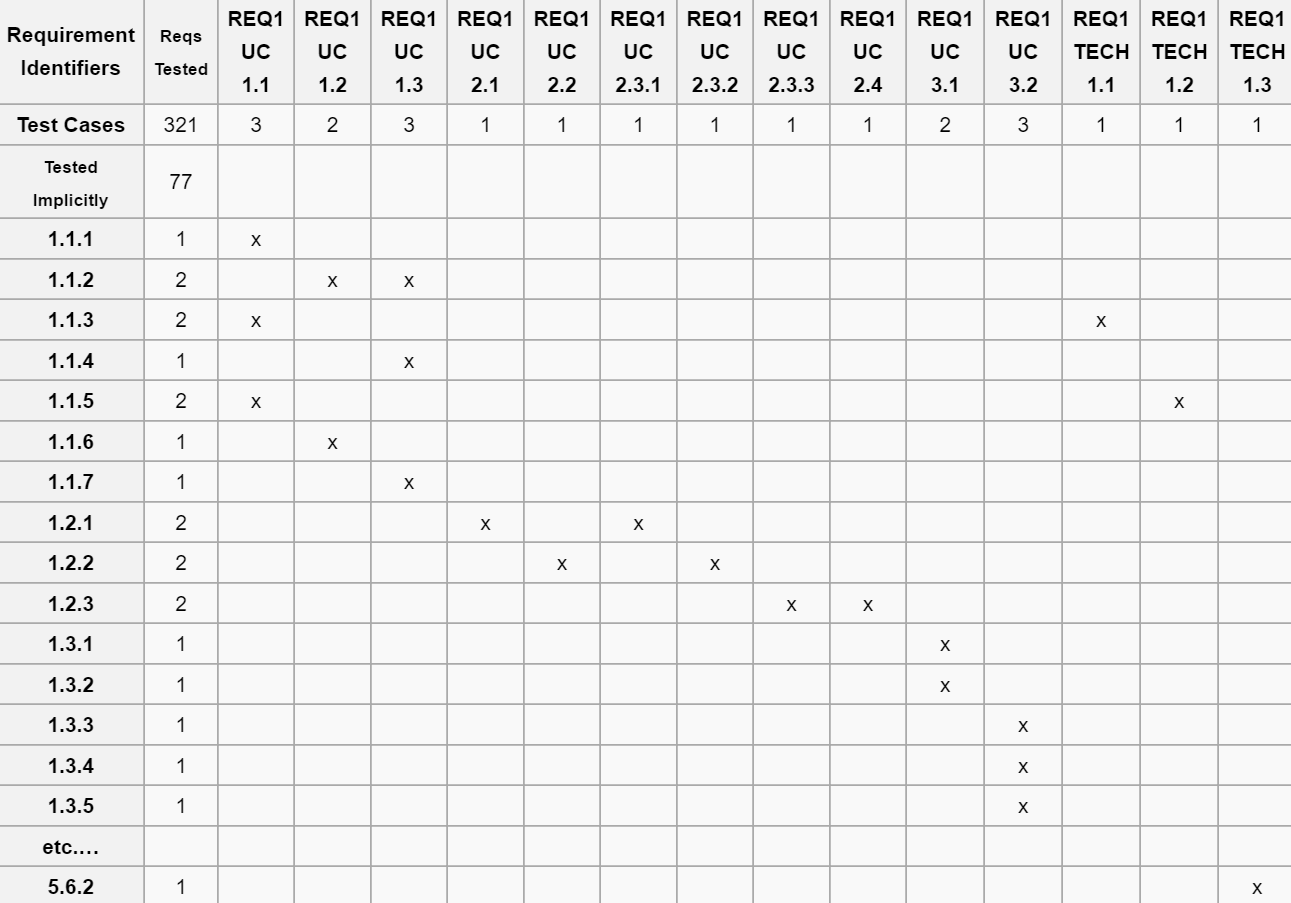
Le test d’un cas doit comprendre :
- Une description du cas testé. Par exemple : valider l'analyse de capabilité pour des données non normales.
- Les Étapes effectuées. Par exemple, Sélectionnez le sous-menu Stat > Outils de la qualité > Analyse des capacités > Non-normal, renseignez la colonne à évaluer et sélectionnez la distribution appropriée.
- Résultats des tests (avec captures d'écran).
- Détermination de la réussite / échec du test.
- Signature et date de l’évaluateur.
Ressources utiles à la validation de Minitab
Il est de la responsabilité de l'acheteur du logiciel de valider le logiciel pour son usage prévu. Si vous utilisez Minitab, nous mettons à votre disposition des ressources pour faciliter votre validation. Vous pouvez télécharger le kit de validation logiciel de Minitab.
Ce kit de validation logiciel a été créé pour vous aider à comprendre comment nous validons Minitab pour sa mise sur le marché et pour confirmer l'engagement continu de Minitab pour la qualité. Sur cette page, vous trouverez notamment des informations supplémentaires sur la validation de Minitab par rapport à la directive FDA CFR Title 21 section 11.



