 – このブログは、MinitabエリアマーケティングマネージャーのAbbie Wongが共同で執筆しました。
– このブログは、MinitabエリアマーケティングマネージャーのAbbie Wongが共同で執筆しました。
COVID-19の影響により世界中で医療機器が不足しているとき、多くのメーカーが需要を満たすために生産ラインを急いで調整しました。アメリカ食品医薬品局(FDA)は、手指消毒剤などの一部の製品に関するガイドラインを一時的に緩和しましたが、医療機器メーカーが製品を市場に届けるには、標準的な承認パスに準拠しなければなりません。
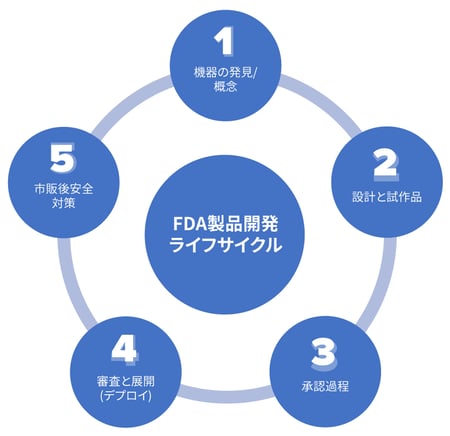
今日は、FDAが推奨する5つのステージの目標と、その中でよく採用される統計手法のいくつかの例を検討します。
ステージ1:機器の発見と概念
必要は発明の母だと聞いたことがあるでしょう。多くの新製品や一般的なイノベーションと同様に、医療機器メーカーは、満たされていないニーズに気付いたため、プロジェクトを開始し、FDAステージの目標に向けて作業を進めることがよくあります。ペースメーカーからカメラを内蔵した錠剤検査機まで、すべての医療機器は概念実証、つまり研究開発エンジニアと技術者がその概念が実用的かどうかを検証することから始まります。
場合によっては、類似した製品がいくつかあることがあります(または、同じ製品であるが材料が異なっている場合もあります)。信頼性、一貫性、およびその他の多くの要因に関するデータをMinitabの変動性図に入れることは、どの製品が最適かを判断するのに役立ちます。
これらおよびいくつかの実例を参照してください

ステージ2:デザインとプロトタイプ
このステージにおいて、研究者は医療機器の初期バージョンを構築します。初期バージョンは人間用ではなく、制御された実験室設定で試験するために使われます。プロトタイプを改良するとき、彼らは人間用製品の使用可能性と危害のリスクを減らす方法についてさらに学び続けます。
例:加速寿命試験を活用した製品ライフサイクルの予測
植込み型医療機器などの一部の製品は、何年も継続的に使われる傾向があります。そのため、すべての医療機器には、保存期間のデータで裏付けられた有効期限付きラベルを付ける必要があります。
障害データを収集するには、研究者はMinitabの加速寿命試験(ALT)技術を適用できます。ALTとは、製品を高温や高圧などの極端な条件の下に置き、製品をより迅速に故障させて製品寿命を検証する試験です。製品をより迅速に故障させることで、必要な試験時間を短縮することができます。次に、故障データを解析して、通常の状況での製品ライフサイクルを推測します。
ステージ3:承認過程
医療機器の承認過程は、そのリスク分類(クラスI、クラスII、またはクラスIII)によって異なります。その安全性と有効性を合理的に保証するために、必要な制御レベルに基づいてすべての機器にクラスが割り当てられます。FDAのWebサイトには、機器の分類方法と各クラスに必要な試験と検証に関する詳細な説明が載せられています。簡単に説明すると、クラスIは包帯、ゴム手袋、電動歯ブラシなどの単純な機器であり、クラスIIIは前の例の埋め込み型医療機器のように、通常生命を維持するためのものを指します。
このステージでは、一定量の製品が製造、テストされ、仕様に対する性能が確認されます。
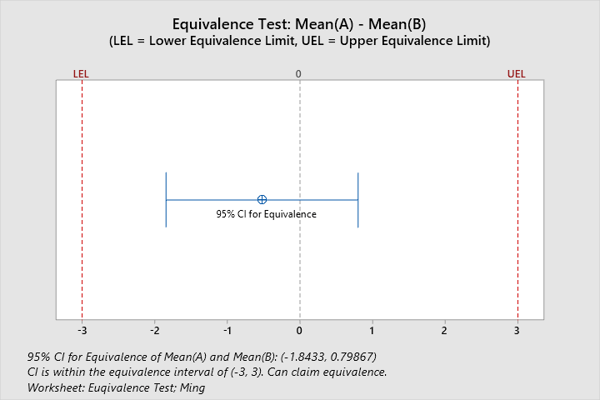
例:同等性検定によって2つの機器が同等であることを証明する
統計的同等性検定は、2つの医療機器が同等であるかどうかを評価するために使用できます。同等性検定とは、同等性の証拠を提供するための分析的アプローチです。同等性検定が実行される場合、従来の帰無仮説とは対立仮説が逆になります。つまり、帰無仮説は2つの機器が同等ではない(その間の差が大きい)ということです。その対立仮説は、それらが同等であること指します。たとえば、研究者が2種類の静脈内投与機器が同量の液体を注入するかどうかを判断したいと考えているとします。その研究者は、科学的同等性のゾーンを3 mL以下の注入量の平均差として定義します。Minitabの同等性検定によると、研究者は平均注入量の差が-1.84334〜0.798674 mLであると95%確信できます。95%信頼区間は-3と3(科学的同等性のゾーン)の間にあるため、2つのIV機器は注入量で同等です。

ステージ4:FDA審査と展開
このステージでは、機器を市場に販売できるように、FDAに申請する準備をします。機器の安全性と有効性に関する十分で認められる情報があることを示したいと思います。プロセスを監視して安定していることを確認しながら、製品が仕様の制限内に制約されることを再確認します。
医療機器の製造プロセスを改善する1つの方法は、統計的工程管理(SPC)プログラムを実装することです。通常、大量生産で使用されるSPCプログラムにより、企業は製品の各バッチを検査するのではなく、管理図を使用して製品を継続的にリリースすることができます。この図は、プロセスの変動の異常なパターンを認識することに役立つ特殊な時系列プロットである図です。
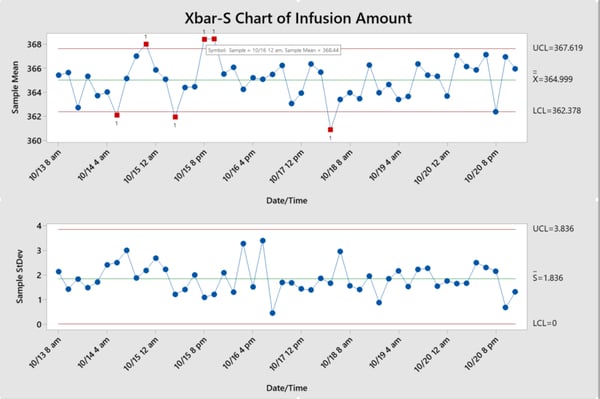
例:静脈内投与機器の注入量の変化をチェックする
約1週間に、各ロットから5つの静脈内投与機器をランダムに選択します。注入量を測定します。エンジニアは、以下の管理図から、どのバッチが制御できていないかを特定することができます。対応するログファイルをチェックすることにより、すべての特有の要因の変動を特定したり排除したりできます。以下に示すように、成功したSPCプログラムは、製造業者が安定したプロセスを維持し、効率を改善し、コストを削減することに役立ちます。
ステージ5:市場投入後安全監視
この時点では製品がもうリリースされたので、製品ラインが適切に保守されていて、プロセスが常に制御されていることを保証するために、生産ラインを適切に監視します。市場投入後調査におけるこのステージでは、機器の不具合や誤動作などの有害事象があった場合には、それが報告されて対処されていることも確認します。FDAはメーカーに対して検査を実施し、製造業者、医療専門家、および消費者が問題を報告できるようにする報告プログラムを採用しています。
例:信頼性分析を活用した予防的メンテナンススケジュールの設計
このステージでは、適切なレベルのサービスを提供し、施設内の機器のダウンタイムを制限します。メンテナンスの1つの形式は、スケジュールされたイベントである予防的メンテナンス(PM)です。PMは、さまざまな段階における医療機器のリスクランキングに従ってスケジュールされます。Minitabの信頼性保存期間研究と多重故障モード分析により、メーカーが製品全体と製品を構成する各コンポーネントのライフサイクルの異なる段階での故障リスクを計算することができます。エンジニアは、ライフサイクルのさまざまな段階で発生する可能性がある障害に応じてメンテナンススケジュールを設計します。
まとめ
医療機器メーカーは、製品ライフサイクルの5つの各ステージで品質と耐久性を確保し、詳細に文書化する必要があります。最後に、Minitabの幅広い分析ツールに関するこれらの例が、製品ライフサイクルの各ステップを理解して作業を進めることに役立つことを願っています。




