A validação do processo é vital para o sucesso de fabricantes de medicamentos, vacinas, kits de teste e vários outros produtos biológicos para uso humano e animal. De acordo com as diretrizes da FDA, a validação do processo é “a coleta e avaliação dos dados, desde o estado de projeto de processo até a produção comercial, que estabelece evidências científicas de que o processo é capaz de gerar consistentemente produtos de qualidade”.
A FDA recomenda três fases para a validação do processo. Vamos explorar os objetivos da etapa e os tipos de atividades e técnicas estatísticas normalmente realizadas em cada um. Você pode usar o Minitab Statistical Software para executar qualquer uma das análises apresentadas aqui. Se você ainda não tem o Minitab, experimente-o gratuitamente por 30 dias.
ESTÁGIO 1: PROJETO DE PROCESSO
Meta: Projete um processo adequado para a fabricação comercial de rotina que pode fornecer consistentemente um produto que atenda aos atributos de qualidade.
É importante demonstrar uma compreensão do processo e descrever como ele responde à várias entradas no projeto de processo.
Exemplo: Identifique os parâmetros críticos do processo com o Planejamento de Experimentos (DOE - Design of Experiments)
Suponha que você precise identificar os parâmetros de processo cruciais para um comprimido de liberação imediata. Existem três variáveis de entrada de processo que você deseja examinar:
- % de enchimento
- % de desintegrante
- tamanho da partícula
Você quer descobrir quais entradas e configurações de entrada maximizarão a porcentagem de dissolução em 30 minutos. O DOE oferece uma estratégia eficiente para a coleta de dados. As entradas são ajustadas simultaneamente para que seja possível identificar se existem relações entre entradas e saída(s).
Execução do experimento: A primeira etapa no DOE é identificar as entradas e os intervalos de entrada correspondentes que você deseja explorar. Em seguida, crie um projeto experimental que sirva como seu plano de coleta de dados.
De acordo com o projeto mostrado nesta tabela, primeiro queremos usar
- um tamanho de partícula de 10
- desintegrante de 1%
- MCC em 33,3%
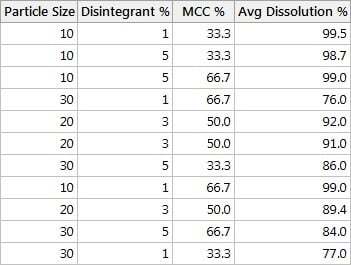
Em seguida, registraremos a porcentagem de dissolução média correspondente usando seis comprimidos de um lote.
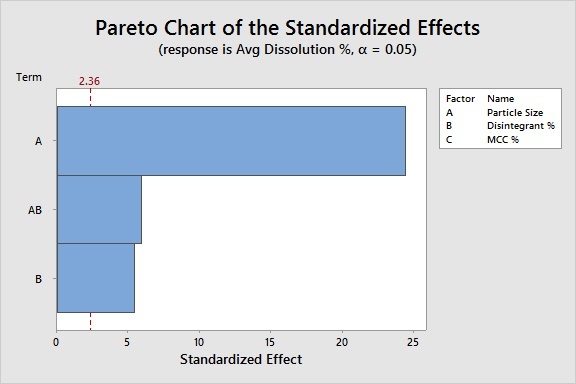
Análise dos dados: Usando a análise DOE e os valores-p, estamos prontos para identificar quais Xs são fundamentais. Com base nas barras que cruzam a linha de significância vermelha neste gráfico de Pareto, podemos concluir que:
O tamanho da partícula e a porcentagem de desintegrante afetam significativamente a porcentagem de dissolução, assim como a interação entre esses dois fatores. A porcentagem de enchimento não é significativa.
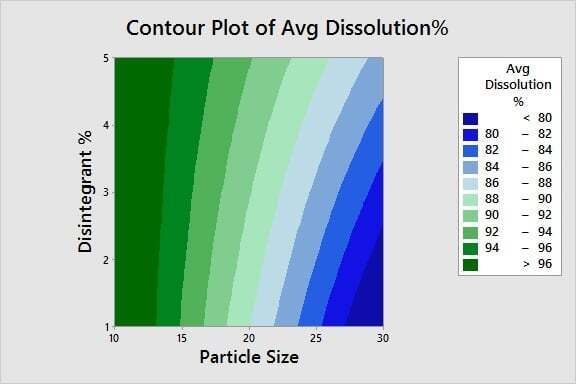
Otimização da qualidade do produto: Agora que identificamos os X fundamentais, estamos prontos para determinar as configurações ideais para essas entradas. Usando um gráfico de contorno, é possível identificar facilmente a janela de processo para as configurações de tamanho da partícula e % de desintegrante necessários para atingir uma porcentagem de dissolução de 80% ou maior.
ESTÁGIO 2: QUALIFICAÇÃO DO PROCESSO
Objetivo: avaliar o projeto de processo para determinar se ele é capaz de reproduzir a fabricação em escala comercial. A conclusão bem-sucedida da etapa 2 é necessária antes da distribuição comercial.
Exemplo 1: avaliar os critérios de aceitação com análise de capacidade
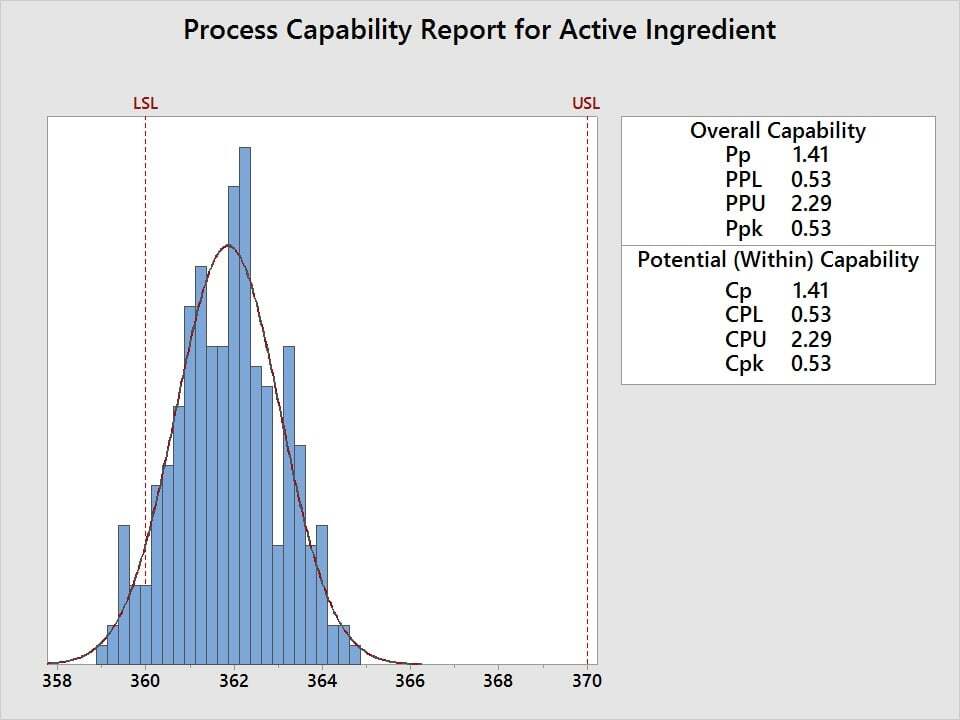
Suponha que a quantidade de ingrediente ativo em um tranquilizante precise estar entre 360 e 370 mg/mL e que seja necessário avaliar o nível da qualidade, em que um Cpk mínimo de 1,33 é definido como critério de aceitação. Para avaliar o desempenho do processo e determinar se as medições estão dentro da especificação, use a análise de capacidade. Cinco amostras são selecionadas aleatoriamente a partir de 50 lotes e a quantidade de ingrediente ativo é medida. Os dados são depois analisados com relação ao mínimo de 360 mg/mL e máximo de 370 mg/mL.
A análise de capacidade revela um Cpk de 0,53, que não atende aos critérios de aceitação de 1,33. As quantidades de ingredientes ativos para este tranquilizante não são aceitáveis. Então, como podemos melhorá-lo?
O valor de Cp de 1,41 e o gráfico revelam que, embora a variabilidade seja aceitável em relação à faixa dos limites de especificação, a média do processo precisa ser deslocada para um mg/mL mais alto para alcançar um Cpk aceitável.
Exemplo 2: Realize a análise de variação entre lotes com boxplots
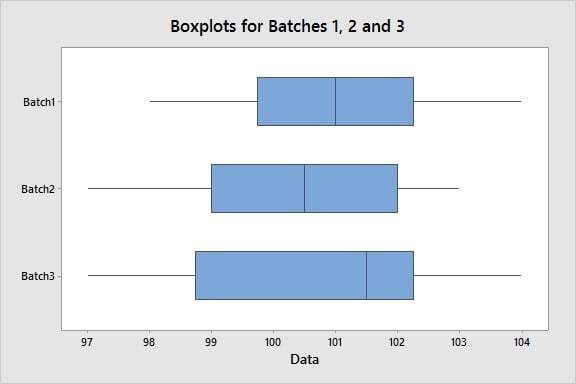
Suponhamos que nosso objetivo é avaliar a uniformidade do conteúdo, uma característica de qualidade crucial, em três lotes em 10 locais. Para visualizar a variação intralote e a variação interlote e identificar quaisquer outliers, podemos criar boxplots para cada lote. Esse gráfico específico mostra uma dispersão homogênea de medições dentro de cada lote e entre lotes. E não há nenhum outlier, o qual o Minitab sinalizaria com um asterisco (*).
Embora os boxplots sejam ferramentas úteis para a realização de uma avaliação visual, também podemos avaliar estatisticamente se há uma diferença significativa na variação entre lotes usando um teste de igualdade de variâncias. O teste releva um valor-p maior que nível alfa de 0,05 (ou qualquer nível alfa de sua preferência), o que respalda a conclusão de que há consistência entre os lotes.
Exemplo 3: várias aplicações para intervalos de tolerância
Outra ferramenta útil para a Qualificação do Processo é o intervalo de tolerância. Esta ferramenta tem várias aplicações. Por exemplo, os intervalos de tolerância podem ser usados para comparar seu processo com as especificações, traçar o perfil do resultado de um processo ou estabelecer critérios de aceitação.
Para uma determinada característica do produto, um intervalo de tolerância fornece uma faixa de valores que provavelmente cobre uma proporção específica da população (por exemplo, 95%) para um nível de confiança especificado (como 99%).
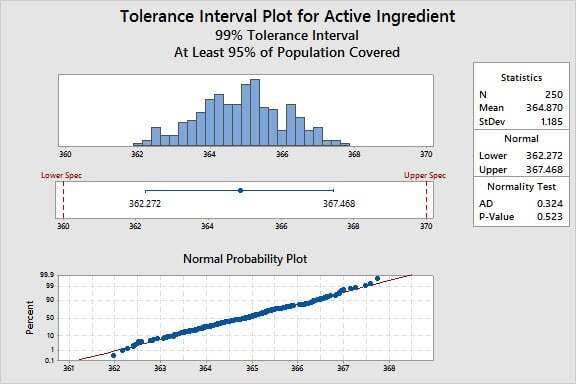
Por exemplo, suponha que desejamos saber como os valores do ingrediente ativo no processo de fabricação se comparam aos nossos limites de especificação. Com base em um estudo de resposta de dose, os limites são 360 a 370 mg/mL.
Para este conjunto de dados específico, o Minitab revela que podemos ter 99% de confiança de que 95% das unidades estarão entre 362,272 e 367,468 mg/mL. Os limites do processo indicam, portanto, que podemos atender aos requisitos de 360 a 370 e concluir com alta confiança que a variação do processo é menor que a variação permitida, definida pelos limites de especificação.
Ou talvez precisemos avaliar a uniformidade do conteúdo usando 99% de confiança e 99% de cobertura. Coletamos 30 comprimidos a título de amostra e calculamos um intervalo de tolerância, revelando que podemos ter 99% de certeza de que 99% dos comprimidos terão uma uniformidade de conteúdo dentro de algum intervalo, calculado usando o Minitab.
ESTÁGIO 3: VERIFICAÇÃO DE PROCESSO PERMANENTE
Objetivo: proporcionar a garantia contínua de que o processo permanece em um estado de controle (o estado validado) durante a fabricação em escala comercial.
Exemplo: Monitorar um processo com cartas de controle
Suponha que você é responsável por monitorar o processo de fabricação de um comprimido oral. Você precisa demonstrar que a dureza é estável ao longo do tempo e detectar se a variação do processo mudou e, portanto, requer atenção.
Você também deve garantir que os operadores da linha de produção não reajam exageradamente a pequenas alterações nos dados, que são inerentes à variabilidade de rotina. Evitar a reações exageradas evita ajustes de processo desnecessários que podem realmente resultar em um aumento não intencional da variabilidade.
Você coleta cinco comprimidos por hora a título de amostra, mede sua dureza e, em seguida, cria um gráfico de controle Xbarra-R.

Este Carta Xbarra-R não revela nenhum ponto sinalizado em vermelho e, portanto, mostra que o processo está sob controle estatístico. Você pode concluir que está mantendo o estado validado do processo e que não há mudanças indesejadas e atípicas na média do processo (conforme o gráfico Xbarra superior) ou na variação (conforme o carta R inferior) que tenham sido detectadas.
Se a carta de controle revelou um estado fora de controle – um processo exposto a fontes de variação imprevistas –, as próximas etapas incluiriam a descrição do problema e a realização de uma investigação de causa raiz. Houve uma mudança nas características do material? Existe algum problema de manutenção ou calibração do equipamento? Ou existe alguma outra fonte de variabilidade que tenha provocado uma mudança no processo?
RESUMINDO
A incapacidade de detectar variação indesejável do processo pode ser atenuada com monitoramento de rotina e gráficos de controle. Além dos gráficos de controle e das ferramentas estatísticas comumente usadas para os estágios Projeto de processo, Qualificação do processo e Verificação contínua do processo, existem outras técnicas estatísticas úteis para contribuir em seus esforços de validação do processo. Por exemplo, o Minitab também inclui amostragem de aceitação para ajudá-lo a calcular o número de amostras a serem coletadas e usar uma amostra de produto escolhida aleatoriamente para determinar se você deve aceitar ou rejeitar um lote inteiro.




